Cấu tạo vỏ nguyên tử là một trong những kiến thức quan trọng trong chương trình Hóa học lớp 10. Để tổng hợp lý thuyết, bài tập cũng như những kiến thức cơ bản về cấu tạo vỏ nguyên tử lớp 10, hãy cùng Toppy theo dõi bài giảng sau.
Xem Tóm Tắt Bài Viết Này
- 1 I. Thành phần cấu tạo vỏ nguyên tử
- 1.1 1. Khái niệm
- 1.2 2. Thành phần
- 2 II. Sự chuyển động của các electron trong nguyên tử:
- 2.1 1. Sự chuyển động của các electron trong nguyên tử:
- 2.2 2. Obitan nguyên tử (Kí hiệu AO):
- 3 III. Lớp e, Phân lớp e:
- 3.1 1. Lớp e:
- 3.2 2. Phân lớp e
- 4 IV. Số electron tối đa trong 1 lớp và phân lớp:
- 4.1 1. Số electron tối đa trong phân lớp:
- 4.2 2. Số electron tối đa trên mỗi lớp:
- 5 V. Dạng bài tập về cấu tạo vỏ nguyên tử:
- 5.1 1. Dựa vào số hạt đã có để xác định được nguyên tố
- 5.2 2. Xác định các thành phần nguyên tử:
- 5.3 3. Viết cấu hình của e:
I. Thành phần cấu tạo vỏ nguyên tử
Để hiểu rõ được cấu tạo vỏ nguyên tử ra sao và cấu tạo vỏ nguyên tử là gì, đầu tiên hãy cùng tìm hiểu khái niệm của nguyên tử ngay sau đây.
1. Khái niệm
Nguyên tử là những hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử vừa có năng lực cấu tạo nên chất vừa có năng lực cấu tạo nên những nguyên tố hóa học .
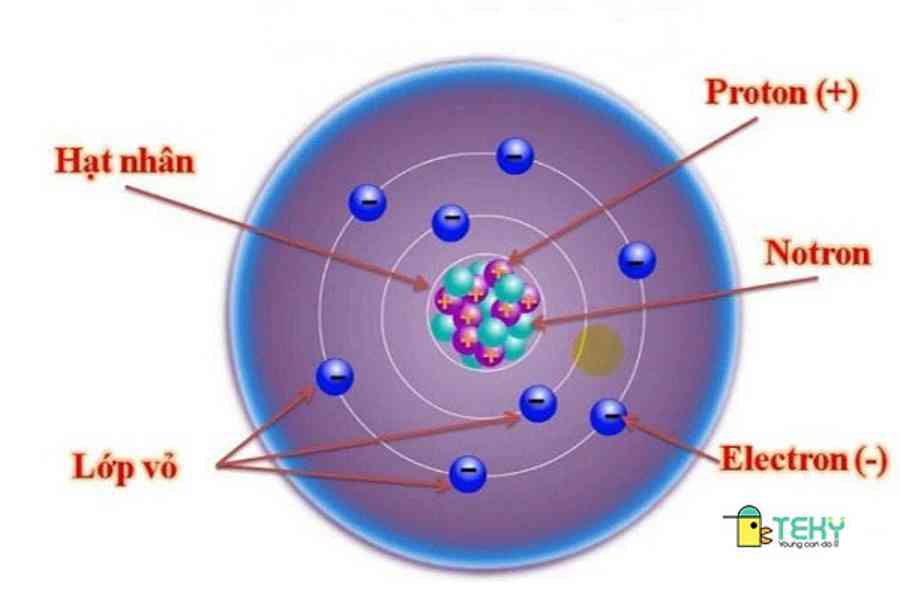
2. Thành phần
Thành phần cấu tạo nên nguyên tử bao gồm vỏ nguyên tử và hạt nhân.
- Vỏ nguyên tử có chứa những electron mang điện tích âm. Như vậycấu tạo vỏ nguyên tửgồm có những electron mang điện tích âm .
- Hạt nhân nằm ở giữa nguyên tử và mang điện tích dương và được tạo ra từ những hạt proton và notron .
Dưới đây là bảng điện tích và khối lượng của những hạt proton, notron và electron .
Hạt
Điện tích
Khối lượng
Proton
qp= – 1,602 x 10– 19C hay qp= 1 +
mp=1,6726. 10- 27kg
Notron
qn= 0
mn=1,6726. 10- 27kg
Electron
qe= – 1,602 x 10- 19C hay qe= 1 –
me= 9,1094 x 10- 31kg
>> Xem thêm: Thành phần nguyên từ và các dạng bài tập hay gặp
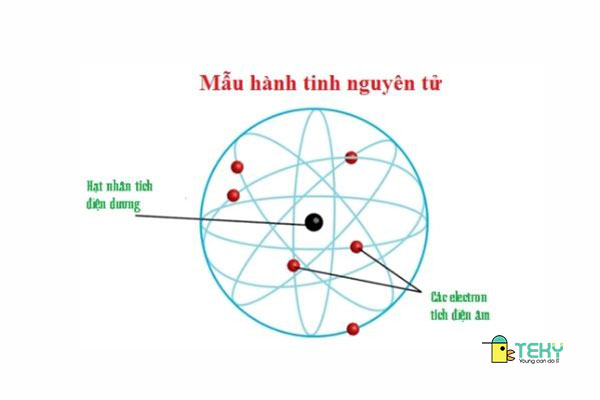
II. Sự chuyển động của các electron trong nguyên tử:
1. Sự chuyển động của các electron trong nguyên tử:
Các electron trong nguyên tử hoạt động rất nhanh ở xung quanh của hạt nhân, tạo thành một đám mây electron và không theo bất kể 1 quỹ đạo nào được xác lập từ trước .
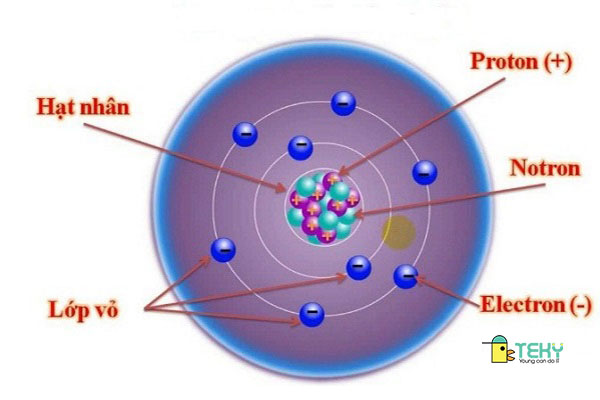
2. Obitan nguyên tử (Kí hiệu AO):
a. Khái niệm :
Obitan nguyên tử ( Kí hiệu AO ) là khu vực đám mây electron nằm xung quanh hạt nhân và chiếm khoảng chừng 90 % Phần Trăm sự xuất hiện của những electron .
b. Hình dạng :
Obitan nguyên tử ( Kí hiệu AO ) dựa vào sự khác nhau của trạng thái electron mà có hai hình dạng là :
- Dạng hình cầu là obitan s .
- Dạng được xu thế với 3 trục Ox, Oy, Oz là obitan p. Đây là obitan gồm 3 loại là obitan px, py, pz và có dạng số 8 nổi .
III. Lớp e, Phân lớp e:
1. Lớp e:
Lớp e là những electron có những mức nguồn năng lượng gần bằng với nhau .
Thứ tự sắp xếp của những lớp e được sắp xếp theo thứ tự từ những mức nguồn năng lượng thấp cho đến những mức nguồn năng lượng cao ( hay còn được biết đến là từ gần nhân cho đến xa nhân ) với 7 lớp electron :
Mức năng lượng n
1
2
3
4
5
6
7
Tên lớp
K
L
M
N
O
P.
Q.
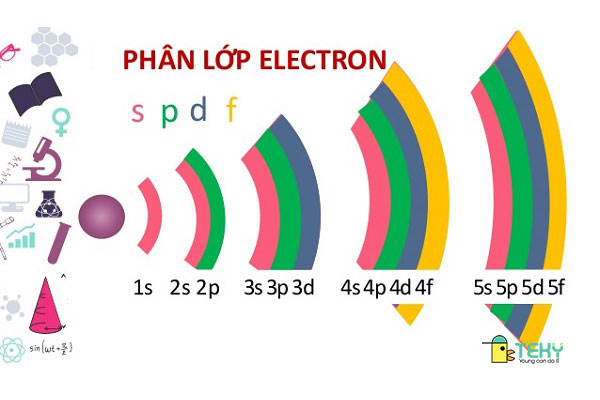
2. Phân lớp e
- Phân lớp e có 4 phân lớp là s, p, d, f và gồm những e có những mức nguồn năng lượng bằng nhau .
- Thông thường mỗi một lớp sẽ chia thành những phân lớp .
- Các electron có trên cùng 1 phân lớp sẽ mang mức nguồn năng lượng bằng nhau .
- Có 4 loại phân lớp là s, p, d, f .
- Lớp thứ n sẽ có n phân lớp và n ≤ 4
IV. Số electron tối đa trong 1 lớp và phân lớp:
>> Ôn lại kiến thức và kỹ năng về Cấu hình electron – Chinh phục hóa học 10 cùng Toppy
1. Số electron tối đa trong phân lớp:
Dưới đây là bảng số electron tối đa trong phân lớp :
Phân lớp
s
p
d
f
Số electron tối đa trong 1 phân lớp
2
6
10
14
Ký hiệu
s2
p6
d10
f14
Do đó so với mỗi phân lớp mà có đủ electron tối đa sẽ được gọi là những phân lớp electron bão hòa .
2. Số electron tối đa trên mỗi lớp:
Lớp thứ n có chứa tối đa là 2 n2 electron ( với n ≤ 4 )
Dưới đây là bảng số electron tối đa trên mỗi lớp
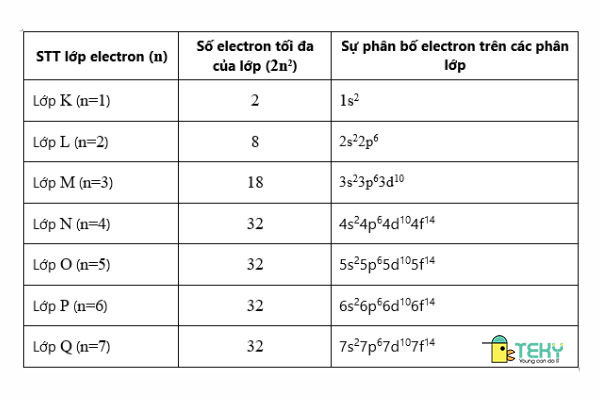
V. Dạng bài tập về cấu tạo vỏ nguyên tử:
Dưới đây là một số dạng bài tập về cấu tạo vỏ nguyên tử thường gặp hiện nay:
1. Dựa vào số hạt đã có để xác định được nguyên tố
Căn cứ vào số Z của nguyên tử để hoàn toàn có thể xác lập được nguyên tử này là nguyên tố hóa học nào .
- Z = p = e = E
- Số khối A = Z + N
- Tổng số hạt mang điện là = Z + E = 2Z
- Tổng số hạt là = 2Z + N
2. Xác định các thành phần nguyên tử:
Cách 1 : Dựa vào cấu tạo của vỏ nguyên tử và ion tương ứng để lập phương trình, sau đó giải ra để tìm được số hạt .
Cách 2 : Dựa vào kí hiệu của nguyên tử sau đó suy ra số hạt của mỗi loại trong nguyên tử
Nhường
Nhận
M → Mn+ ne
X + me → Xm –
3. Viết cấu hình của e:
Bước 1 : Tiến hành xác lập số electron có trong nguyên tử
Bước 2 : Thực hiện phân bổ những electron với thứ tự mức nguồn năng lượng của obitan tăng dần .
Bước 3 : Tiến hành viết thông số kỹ thuật của những e theo thứ tự của những phân lớp electron trong một lớp .
Lưu ý khi viết thông số kỹ thuật e :
- Trật tự tăng dần của những mức nguồn năng lượng obitan như sau 1 s2s2p3s3p4s3d4p5d5p6s4f5d6p7s5f6d7p .
- Dạng ( n-1 ) d4ns2, ( n-1 ) d9ns2sẽ được chuyển thành ( n-1 ) d5ns1và ( n-1 ) d10
ns
1
Bài viết trên đã cung cấp thông tin về cấu tạo vỏ nguyên tử hóa 10 cũng như dạng bài tập thường gặp về cấu tạo vỏ nguyên tử giúp các em hệ thống hóa lại kiến thức và ôn tập hiệu quả. Trong quá trình học tập và ôn luyện, nếu có nhu cầu tìm kiếm đơn vị học tập uy tín, chất lượng hoặc muốn được giải đáp về những kiến thức liên quan đến môn học, hãy liên hệ với Toppy để được giải đáp nhanh nhất có thể.
Xem thêm những bài viết thuộc chủ đề khác tại :
Source: https://sangtaotrongtamtay.vn
Category: Khoa học