- A1.
-
B
Bạn đang đọc: 20 bài tập vận dụng về cấu hình electron có lời giải">20 bài tập vận dụng về cấu hình electron có lời giải
2.
- C6.
- D7.
Đáp án: A
Phương pháp giải :Trong nguyên tử có 3 loại hạt cơ bản là : p, n, e
Trong đó :
+ Số p = số e = Z ( mang điện )
+ Số n = N ( không mang điện )Lời giải chi tiết cụ thể :Đặt số p = số e = Z ; số n = N
– Tổng số hạt cơ bản p, n, e là 34 hạt → 2Z + N = 34 ( 1 )
– Số hạt mang điện ( p, e ) nhiều hơn số hạt không mang điện ( n ) là 10 hạt → 2Z – N = 10 ( 2 )
Giải ( 1 ) và ( 2 ) ⟹ Z = 11, N = 12
→ Cấu hình e của X : 1 s22s22p63s1
→ Số e lớp ngoài cùng là 1
Đáp án A
Đáp án – Lời giải Câu hỏi 2 :Nguyên tử nguyên tố Y có số khối là 16. Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện. Cấu hình electron của Y là
- A1s22s22p4.
- B1s22s22p63s23p4.
- C1s22s22p6.
- D1s22s22p63s23p6.
Đáp án: A
Phương pháp giải :- Số khối : A = Z + N
– Hạt nhân chứa p ( mang điện ) và n ( không mang điện )Lời giải cụ thể :- Nguyên tử nguyên tố Y có số khối là 16 → Z + N = 16 ( 1 )
– Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện → Z = N ( 2 )
Giải ( 1 ) và ( 2 ) ⟹ Z = N = 8
→ Cấu hình e của Y : 1 s22s22p4
Đáp án A
Đáp án – Lời giải Câu hỏi 3 :Tổng số hạt trong nguyên tử của nguyên tố X là 40. Nguyên tử X có 3 electron ở lớp ngoài cùng. Số hiệu nguyên tử của X là :
- A13
- B12
- C11
- D31
Đáp án: A
Lời giải cụ thể :
Đáp án A
Tổng số hạt : p + n + e = 40 => 2 p + n = 40
Lại có : p ≤ n ≤ 1,5 p
=> p ≤ ( 40 – 2 p ) ≤ 1,5 p
=> 11,4 ≤ p ≤ 13,3
=> p = 12 hoặc p = 13
+ ) Nếu p = 12 => Cấu hình e : 1 s22s22p63s2
+ ) Nếu p = 13 => Cấu hình e : 1 s22s22p63s23p1
X có 3 electron ở lớp ngoài cùng => p = 13Đáp án – Lời giải Câu hỏi 4 :Tổng số hạt p, n, e trong nguyên tử nguyên tố A là 22. Vậy cấu hình electron của A là :
- A1s2 2s2 2p4 .
- B1s2 2s2 2p2 .
- C1s2 2s2 2p3.
- D1s2 2s2 2p5.
Đáp án: C
Lời giải chi tiết cụ thể :
Đáp án C
Tổng số hạt : p + n + e = 22 => 2 p + n = 22
Lại có : p ≤ n ≤ 1,5 p
=> p ≤ ( 22 – 2 p ) ≤ 1,5 p
=> 6,2 ≤ p ≤ 7,3
=> p = 7 = e
=> Cấu hình e : 1 s22s22p3Đáp án – Lời giải Câu hỏi 5 :Một nguyên tử có kí hiệu là \ ( { } _ { 21 } ^ { 45 } X \ ), cấu hình electron của nguyên tử X là :
- A1s2 2s2 2p6 3s2 3p6 4s2 3d1.
- B1s2 2s2 2p6 3s2 3p6 4s1 3d2.
- C1s2 2s2 2p6 3s2 3p6 3d3.
- D1s2 2s2 2p6 3s2 3p6 3d1 4s2.
Đáp án: D
Lời giải chi tiết cụ thể :1 s2 2 s2 2 p6 3 s2 3 p6 3 d1 4 s2 .Đáp án – Lời giải Câu hỏi 6 :Cation R + có cấu hình e lớp ngoài cùng là 3 p6. Cấu hình electron vừa đủ của R là
- A1s22s22p63s23p6
- B1s22s22p63s23p5
- C1s22s22p63s23p63d1
- D1s22s22p63s23p64s1
Đáp án: D
Lời giải cụ thể :
Đáp án D
R + có cấu hình e lớp ngoài cùng là 3 p6
=> R có : 4 s1
Cấu hình e không thiếu : 1 s22s22p63s23p64s1Đáp án – Lời giải Câu hỏi 7 :Cho số điện tích hạt nhân của nguyên tử là : X ( Z = 6 ) ; Y ( Z = 7 ) ; M ( Z = 13 ) ; T ( Z = 18 ) ; Q. ( Z = 19 ). Số nguyên tố có tính sắt kẽm kim loại là :
- A3
- B4
- C2
- D1
Đáp án: C
Lời giải chi tiết cụ thể :
Đáp án C
X ( Z = 6 ) : 1 s22s22p2
Y ( Z = 7 ) : 1 s22s22p3
M ( Z = 13 ) : 1 s22s22p63s23p1
T ( Z = 18 ) : 1 s22s22p63s23p6
Q. ( Z = 19 ) : 1 s22s22p63s23p64s1
Kim loại khi tổng số e lớp ngoài cùng ≤ 3
=> Chỉ có M và Q.Đáp án – Lời giải Câu hỏi 8 :
Cho số hiệu nguyên tử của các nguyên tố O, K, Ca, Fe lần lượt là 8, 19, 20, 26. Cấu hình electron của ion nào sau đây không giống cấu hình của khí hiếm:
- AO2-
- BCa2+
- CFe2+
- DK+
Đáp án: C
Lời giải chi tiết cụ thể :
Đáp án C
O ( Z = 8 ) : 1 s22s22p4
K ( Z = 19 ) : 1 s22s22p63s23p64s1
Ca ( Z = 20 ) : 1 s22s22p63s23p64s2
Fe ( Z = 26 ) : 1 s22s22p63s23p63d64s2Đáp án – Lời giải Câu hỏi 9 :Phân lớp có mức nguồn năng lượng cao nhất của ion X2 + là 3 d, chứa 6 e. Cấu hình electron của X là :
- A1s22s22p63s23p63d64s2
- B1s22s22p63s23p63d6
- C1s22s22p63s23p63d8
- D1s22s22p63s23p63d84s2
Đáp án: A
Lời giải chi tiết cụ thể :X có cấu hình e là 1 s22s22p63s23p63d64s2
Đáp án AĐáp án – Lời giải Câu hỏi 10 :Nguyên tử của nguyên tố X có e sau cuối điền vào phân lớp 3 p1. Nguyên tử nguyên tố Y có e ở đầu cuối điền vào phân lớp 3 p3. Số proton của X, Y lần lượt là :
- A13 và 15
- B12 và 14
- C13 và 14
- D12 và 15
Đáp án: A
Lời giải chi tiết cụ thể :
Đáp án A
X : 1 s22s22p63s23p1 : có 13 electron
Y : 1 s22s22p63s23p3 : có 15 electronĐáp án – Lời giải Câu hỏi 11 :Nguyên tử X có tổng số hạt p, n, e là 52 và số khối là 35. Cấu hình electron của X là :
- A1s22s22p63s23p6
- B1s22s22p63s23p5
- C1s22s22p63s23p4
- D1s22s22p63s23p64s23d105s24p3
Đáp án: B
Lời giải cụ thể :
Đáp án B
Z = số E và A = số P + số N = Số E + số N
=> 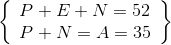 => số E = 17
=> số E = 17
Z = 17 : 1 s22s22p63s23p5Đáp án – Lời giải Câu hỏi 12 :Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np5. Trong hợp chất khí của nguyên tố X với hidro, X chiếm 98,765 % khối lượng. Nguyên tố X tạo với sắt kẽm kim loại M hợp chất có công thức MX2, trong đó M chiếm 28,89 % về khối lượng. Tìm tên sắt kẽm kim loại M .
( cho biết : Cu = 64 ; Mg = 24 ; Zn = 65 ; Fe = 56 )
- ACu
- BMg
- CZn
-
D
Fe
Đáp án: C
Phương pháp giải :X có cấu hình electron lớp ngoài cùng là ns2np5 => Trong hợp chất oxit cao nhất X có hóa trị VII
=> Trong hợp chất khí với H, X có hóa trị I => Công thức hóa học của hợp chất khí với H : HX
Trong HX, Xác Suất khối lượng của X : \ ( \ % { m_X } = \ frac { { { M_X } } } { { 1 + { M_X } } }. 100 \ % = 98,765 \ % \ to { M_X } = ? \ )
Trong MX2 : \ ( \ % { m_M } = \ frac { { { M_M } } } { { { M_M } + 2. { M_X } } }. 100 \ % = 28,89 \ % \ to { M_M } = ? \ )Lời giải chi tiết cụ thể :X có cấu hình electron lớp ngoài cùng là ns2np5 => Trong hợp chất oxit cao nhất X có hóa trị VII
=> Trong hợp chất khí với H, X có hóa trị I => Công thức hóa học của hợp chất khí với H : HX
Trong HX, Tỷ Lệ khối lượng của X : \ ( \ % { m_X } = \ frac { { { M_X } } } { { 1 + { M_X } } }. 100 \ % = 98,765 \ % \ to { M_X } = 80 \ ) => X là Br
Trong MBr2 : \ ( \ % { m_M } = \ frac { { { M_M } } } { { { M_M } + 2.80 } }. 100 \ % = 28,89 \ % \ to { M_M } = 65 \ ) => M là Zn
Đáp án C
Đáp án – Lời giải Câu hỏi 13 :Cho những nguyên tố có số hiệu nguyên tử lần lượt là Y ( Z = 3 ) ; Z ( Z = 7 ) ; E ( Z = 12 ) ; T ( Z = 18 ) ; R ( Z = 19 ). Dãy gồm những nguyên tố sắt kẽm kim loại là ?
- AY ; T; R
- BE; T ; R
- CY; E; T
- DY; E; R
Đáp án: D
Phương pháp giải :Viết cấu hình e của những nguyên tử ra, những nguyên tử có số e lớp ngoài cùng là 1,2,3 e → đó là nguyên tố sắt kẽm kim loại .Lời giải cụ thể :Cấu hình e của những nguyên tố :
Y (Z=3): 1s22s1→ có 1e lớp ngoài cùng
Z (Z = 7): 1s22s22p3→ có 5e lớp ngoài cùng
E (Z=12): 1s22s22p63s2 → có 2e lớp ngoài cùng
T (Z=18): 1s22s22p63s23p6 → có 8e lớp ngoài cùng
R (Z = 19): 1s22s22p63s23p64s1→ có 1e lớp ngoài cùng
→ 3 nguyên tử Y, E, R có 1-3 electron lớp ngoài cùng nên là nguyên tố sắt kẽm kim loại
Đáp án D
Đáp án – Lời giải Câu hỏi 14 :Nguyên tử X có tổng số hạt là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Khẳng định nào sau đây là đúng ?
- AX là phi kim.
- BĐiện tích hạt nhân của nguyên tử X là + 2,0826.10-18 C.
- CX là nguyên tố s
- DỞ trang thái cơ bản nguyên tử X có 1electron p
Đáp án: B
Phương pháp giải :Gọi số hạt trong X là : p, n, e. Ta có hệ phương trình
\(\left\{ \matrix{
{\rm{2p + n = 40}} \hfill \cr
{\rm{2p – n = 12}} \hfill \cr} \right. \to \left\{ \matrix{
{\rm{p = ?}} \hfill \cr
{\rm{n = ?}} \hfill \cr} \right.\)
Có số p → Viết được cấu hình e của X. Từ đó suy ra những Tóm lại nào đúng, saiLời giải cụ thể :Gọi số hạt trong X là : p, n, e. Ta có hệ phương trình
\(\left\{ \matrix{
{\rm{2p + n = 40}} \hfill \cr
{\rm{2p – n = 12}} \hfill \cr} \right. \to \left\{ \matrix{
{\rm{p = 13}} \hfill \cr
{\rm{n = 14}} \hfill \cr} \right.\)
X ( Z = 13 ) : 1 s22s22p63s23p1
Điện tích hạt nhân của X : + 13.1,602. 10-19 =. + 2,0826. 10-18 C → B đúng
X là sắt kẽm kim loại do có 3 e ở lớp ngoài cùng → A sai
X là nguyên tố p do electron ở đầu cuối điền vào phân lớp p, X có 7 electron p → C, D sai
Đáp án B
Đáp án – Lời giải Câu hỏi 15 :Nguyên tử của nguyên tố X có tổng số electron trong những phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
- A3s23p5
- B2s22p4.
- C3s23p4.
- D3s23p3
Đáp án: A
Phương pháp giải :X có 7 electron p → viết được cấu hình e của X → pX = ?
Dựa vào dữ kiện bài toán suy ra pY = ?. Từ đó viết được cấu hình e của YLời giải chi tiết cụ thể :X có 7 electron p → X : 1 s22s22p63s23p1 → X có số p = 13
Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8 nên :
2 py = 13.2 + 8 → py = 17
→ Y: 1s22s22p63s23p5
Đáp án A
Đáp án – Lời giải Câu hỏi 16 :
Tổng các hạt trong nguyên tử Y là 13. Số hạt mang điện dương ít hơn số hạt không mang điện là 1. Nhận xét nào sau đây không đúng?
- AY là phi kim
- BY có số p, n, e lần lượt là: 4, 5, 4.
- CY có 2 electrong lớp ngoài cùng
- DY có điện tích hạt nhân là: +6,408.10-19C
Đáp án: A
Phương pháp giải :Giải hệ phương trình với dữ kiện đề bài cho, tìm được số p, n, e của Y
Từ đó viết được cấu hình của Y và nhận xét được nhận định và đánh giá đúng, saiLời giải cụ thể :Gọi số hạt trong Y là : p, n, e. Có
\(\left\{ \matrix{
{\rm{2p + n = 13}} \hfill \cr
{\rm{ – p + n = 1}} \hfill \cr} \right. \to \left\{ \matrix{
{\rm{p = 4}} \hfill \cr
{\rm{n = 5}} \hfill \cr} \right.\)
→ Cấu hình Y : 1 s22s2. Y có số p, n, e lần lượt là : 4, 5, 4. → B đúng
Y là sắt kẽm kim loại vì có 2 e lớp ngoài cùng → C đúng, A sai
Điện tích hạt nhân của Y : + 4.1,602. 10-19 = + 6,408. 10-19 C → D đúng
Đáp án A
Đáp án – Lời giải Câu hỏi 17 :
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Tính chất của nguyên tố X, Y lần lượt là
- Akhí hiếm và kim loại.
- Bphi kim và kim loại.
- Ckim loại và khí hiếm.
- Dkim loại và kim loại.
Đáp án: B
Phương pháp giải :Viết những cấu hình electron, dựa vào số electron lớp ngoài cùng để kiểm tra tính sắt kẽm kim loại, phi kim .Lời giải chi tiết cụ thể :X : 1 s22s22p63s23px ( x ε [ 1, 6 ] )
Y : Y có 1 electron lớp ngoài cùng → electron này phải thuộc phân lớp s ; Y cũng có electron thuộc 3 p
=> Y có nhiều electron hơn X 2 electron => EY = 19 và EX = 17 => ZY = 19 và ZX = 17
X : 1 s22s22p63s23p5 ( có 7 e lớp ngoài cùng → phi kim ) ;
Y : 1 s22s22p63s23p64s1 ( có 1 e lớp ngoài cùng → sắt kẽm kim loại )
Đáp án B
Đáp án – Lời giải Câu hỏi 18 :Một ion M3 + có tổng số hạt proton, notron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Viết cấu hình electron của nguyên tử M ?
- A[Ar]3d54s1
- B[Ar]3d64s2
- C[Ar]3d64s1
- D[Ar]3d34s2
Đáp án: B
Phương pháp giải :Ta có : M → M3 + + 3 e
Lập 2 phương trình về mối quan hệ giữa những hạt trong ion M3 + để tìm số e của nguyên tử M, từ đó viết được cấu hình e của nguyên tử M .Lời giải cụ thể :Một ion M3 + có tổng số hạt proton, notron và electron là 79 → 2Z + N – 3 = 79
Số hạt mang điện nhiều hơn số hạt không mang điện là 19 → 2Z – 3 – N = 19
Giải hệ trên ta có Z = 26 và N = 30
Với Z = 26 ta có cấu hình electron nguyên tử là 1 s22s22p63s23p63d64s2 hay [ Ar ] 3 d64s2
Đáp án B
Đáp án – Lời giải Câu hỏi 19 :Nguyên tử nguyên tố T có cấu hình electron lớp ngoài cùng là 4 s2. Số lượng nguyên tố T là
- A1.
- B3.
- C6.
- D9.
Đáp án: D
Phương pháp giải :Cấu hình e của T có dạng : 1 s22s22p63s23p63dx4s2
Xác định những giá trị hoàn toàn có thể có của x ( quan tâm hiện tượng kỳ lạ nhảy e để đạt cấu hình bán bão hòa và cấu hình bão hòa )Lời giải chi tiết cụ thể :Cấu hình e của T có dạng : 1 s22s22p63s23p63dx4s2
Các giá trị hoàn toàn có thể có của x là :
x = 0 ; 1 ; 2 ; 3 ; 5 ; 6 ; 7 ; 8 ; 10
( x không hề nhận giá trị 4 và 9 vì có hiện tượng kỳ lạ nhảy e để đạt cấu hình bán bão hòa và cấu hình bão hòa )
Đáp án D
Đáp án – Lời giải Câu hỏi 20 :Trong ion R +, tổng số hạt cơ bản là 57 hạt. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 17 hạt. Số electron độc thân của R là
- A1.
- B2.
- C3.
- D0.
Đáp án: A
Phương pháp giải :Trong R có : số p = số e = Z ; số n = N
⟹ Trong R + có : số p = Z ; số e = Z – 1 ; số n = N
– Dựa vào dữ kiện lập hệ 2 phương trình. Giải tìm được Z, N
– Viết cấu hình e nguyên tử
– Xác định số e độc thânLời giải chi tiết cụ thể :Trong R có : số p = số e = Z ; số n = N
⟹ Trong R + có : số p = Z ; số e = Z – 1 ; số n = N
+ ) Tổng hạt trong ion R + là 57
⟹ ( 2Z – 1 ) + N = 57 ⇔ 2Z + N = 58 ( 1 )
+ ) Số hạt mang điện ( p, e ) nhiều hơn số hạt không mang điện là 17
⟹ ( 2Z – 1 ) – N = 17 ⇔ 2Z – N = 18 ( 2 )
Giải (1) (2) được Z = 19 và N = 29
Xem thêm: Cách chơi FO4 không cần card màn hình
⟹ Cấu hình e : 1 s22s22p63s23p64s1
⟹ Chỉ có duy nhất phân lớp 4 s chưa bão hòa nên số e độc thân là 1 .
Đáp án A
Đáp án – Lời giải
Source: https://sangtaotrongtamtay.vn
Category: Công nghệ

